Por Omar Lozano-García y Helen Y. Lorenzo-Anota
Actualmente, en el mundo existen más de 2 mil millones de personas con obesidad, y México se ubica como el quinto país con mayor prevalencia. La Encuesta Nacional de Salud evidenció que el 75.2% de los adultos padece sobrepeso u obesidad. Estas alarmantes estadísticas sugieren que, para el 2030, cerca del 40% de los adultos mexicanos será diagnosticado con problemas de obesidad. Además, nuestro país ocupa el primer lugar en obesidad infantil a nivel global. Esto significa que de cada 20 niños menores de cinco años, al menos uno padece sobrepeso u obesidad. Esta cifra se eleva a uno de cada tres en niños de entre seis y 19 años. Esta alta prevalencia tiene graves implicaciones económicas, pues se estima que las consecuencias (de salud, económicas, sociales) de padecer obesidad en México representan el 5% del PIB (producto interno bruto).
De acuerdo con la relación peso-talla de un individuo, la obesidad es un exceso en la acumulación de grasa corporal. El impacto principal es que aumenta la probabilidad de desarrollar otras enfermedades con mayor mortalidad, como diabetes mellitus tipo II, padecimientos cardiovasculares, síndrome metabólico, hipertensión, enfermedad del hígado graso no alcohólico, una amplia variedad de tipos de cáncer y depresión (Lin & Li, 2021; Redinger, 2007).
Para evitar la progresión, es importante primero entender las alteraciones fisiológicas que acompañan la acumulación de la grasa corporal en el paciente obeso.
Tejido adiposo: almacén de grasa corporal
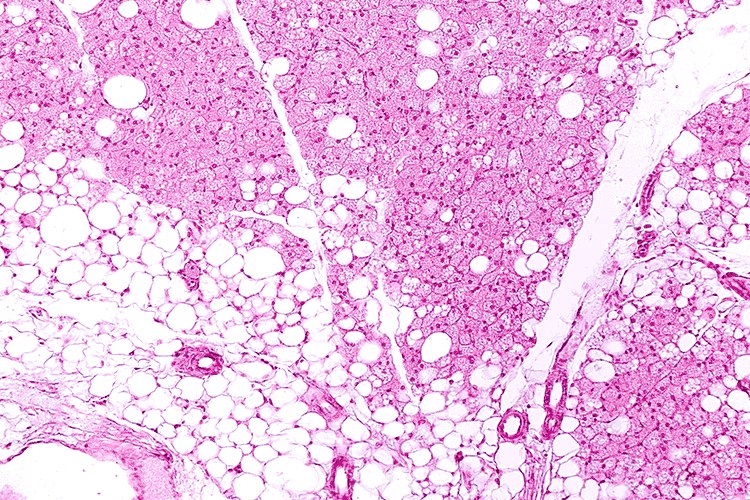
De manera saludable, la grasa corporal se almacena como tejido adiposo, acumulado en regiones como la zona abdominal, la espalda, las piernas y la cara. Este tejido está constituido entre un 80 y 90% por adipocitos, células altamente especializadas en el almacenamiento de grasa. De acuerdo con sus características morfológicas y bioquímicas, se diferencian de manera particular en tres subtipos: blanco, beige y pardo (Hadi et al., 2019; González Jiménez, 2013; Mayoral et al., 2020). Sus principales funciones son el reservorio de grasa para la obtención de energía y la producción de moléculas que regulan otras funciones como el hambre y el sistema inmunológico.
Bajo condiciones no saludables como en la obesidad, el tejido adiposo no cumple sus funciones, además de que surgen perturbaciones en los adipocitos, como el aumento en su tamaño, el incremento en inflamación y la disminución de la sensibilidad de la hormona que regula los niveles de glucosa en sangre (insulina). Todos estos cambios sugieren que el tejido adiposo es blanco ideal para la innovación de tratamientos para combatir la obesidad.
La urgencia por crear tratamientos para la obesidad
Las principales estrategias para disminuir la grasa corporal son cambios en los hábitos diarios, una alimentación saludable y actividad física. Además, la Administración de Drogas y Alimentos (FDA) de Estados Unidos ha aprobado el uso de medicamentos y dispositivos, así como cirugías bariátricas para promover la pérdida de grasa corporal del paciente obeso. Sin embargo, la gran mayoría están limitados por su falta de especificidad, aumentando el riesgo de desarrollar tumores, y la insostenibilidad de los efectos a largo plazo –efecto rebote–, sumado a los extravagantes costos que le generan al paciente (Khera et al., 2016). Por lo tanto, se requieren urgentemente novedosos y mejorados enfoques para el tratamiento de la obesidad.
Una de estas rutas son estrategias dirigidas de manera selectiva al tejido adiposo, que sean capaces de restaurar la función convencional de los adipocitos. Tratamientos recientes como la semaglutida han tenido resultados muy alentadores para pacientes con obesidad, quienes han reducido alrededor del 10% de su peso corporal; sin embargo, tiene varias desventajas, incluidos efectos secundarios acentuados, la necesidad de consumir permanentemente el medicamento para mantener los cambios obtenidos y su alto costo actual.
Avances nanotecnológicos
En las últimas décadas, la nanotecnología, sistemas con tamaños alrededor de 100 nanómetros (mil veces más pequeño que el diámetro del cabello humano), como las nanopartículas (NPs), ha ofrecido novedosos enfoques para el área de la salud: una entrega dirigida al tejido u órgano objetivo que libere el fármaco de manera controlada y constante, requiriendo menos dosis y administraciones, aunada a una reducción de efectos secundarios. Estos sistemas pueden diseñarse para viajar por la sangre y llegar a un tejido u órgano objetivo, como el tejido graso, para entregar el fármaco.
En los últimos años, se han utilizado para el tratamiento de la obesidad por medio de su acción en adipocitos. Estos son algunos ejemplos:
- Investigadores han utilizado NPs de oro, algunas cargadas con extractos de plantas medicinales como la del té verde, logrando pérdida de grasa en adipocitos (Simu et al., 2018; Akter et al., 2022) y disminución en los niveles de inflamación, glucosa y lípidos en sangre de ratones obesos, además de favorecer la pérdida de peso (Chen et al., 2018; Lei Gao et al., 2020).
- Los liposomas –NPs a base de fosfolípidos (estructuras como las membranas celulares)– también se han estudiado como sistemas de entrega de fármacos contra la obesidad: la entrega de péptidos que favorecen la pérdida de peso de ratones obesos disminuye los lípidos en sangre y evita la resistencia a la insulina (Jiang et al., 2017); la entrega de compuestos producidos en cuerpo como citocinas antiinflamatorias reduce la inflamación (Toita et al., 2016), y la entrega de L-carnitina favorece el metabolismo de lípidos (Yaşacan et al., 2020).
- Las NPs poliméricas –a base de polímeros biocompatibles y biodegradables– se han utilizado con éxito para la liberación controlada y sostenida de fármacos contra la obesidad: la entrega de extractos de plantas medicinales o quercetina (el antioxidante más disponible en frutas y verduras) favoreció la pérdida de peso en ratones obesos (Abu et al., 2013, Ahmed et al., 2021), mejorando el efecto antiobesogénico de extractos de plantas; asimismo, la entrega de fármacos para otro tipo de enfermedades como la rosiglitazona (usada en diabetes) o la dibenzazepina (usada como antidepresivo) ha reducido la inflamación del tejido adiposo y previene la formación de nuevo tejido adiposo en ratones obesos, mejorando su manejo en glucosa y atenuando la ganancia de peso corporal de los ratones (Di Mascolo et al., 2013, Jiang et al., 2017).
Actualmente, el Institute for Obesity Research del Tecnológico de Monterrey busca encontrar soluciones contra esta enfermedad. Uno de sus proyectos de investigación tiene como propósito el desarrollo de nuevas formulaciones contra la obesidad en la infancia temprana. Este proyecto se basa en la identificación de novedosos compuestos para el tratamiento de la obesidad y su entrega por medio de NPs, biocompatibles y biodegradables, a través de estrategias de direccionamiento al tejido adiposo para entregar de manera controlada y sostenida fármacos que ayuden a reducir este padecimiento.
Esperanza nanotecnológica
La lucha por la prevención y el tratamiento de la obesidad es una emergencia en todo el mundo. Al día de hoy, las limitantes se encuentran en los efectos secundarios graves y en la baja efectividad a largo plazo.
La implementación de la nanotecnología en el tratamiento de la obesidad ofrece oportunidades que apoyan con la pérdida de peso y la prevención de los trastornos metabólicos en el paciente.
Referencias
Ahmed, H. H., Kotob, S. E., Abd-Rabou, A. A., Aglan, H. A., Elmegeed, G. A., & Mohawed, O. A. (2021). Pre-Clinical Evidence for the Anti-Obesity Potential of Quercetin and Curcumin Loaded Chitosan/PEG Blended PLGA Nanoparticles. Biomedical and Pharmacology Journal, 14(4), 1731–1759. https://doi.org/10.13005/bpj/2274
Akbarzadeh, A., Rezaei-Sadabady, R., Davaran, S., Joo, S. W., Zarghami, N., Hanifehpour, Y., Samiei, M., Kouhi, M., & Nejati-Koshki, K. (2013). Liposome: Classification, preparation, and applications. Nanoscale Research Letters, 8(1). https://doi.org/10.1186/1556-276X-8-102
Akter, R., Ling, L., Rupa, E. J., Kyupark, J., Mathiyalagan, R., Nahar, J., Won, L. J., Hyun, K., Murugesan, M., Yang, D. C., Kang, S. C., & Kwak, G. Y. (2022). Binary Effects of Gynostemma Gold Nanoparticles on Obesity and Inflammation via Downregulation of PPARγ/CEPBα and TNF-α Gene Expression. Molecules, 27(9). https://doi.org/10.3390/molecules27092795
Chen, H., Ng, J. P. M., Tan, Y., McGrath, K., Bishop, D. P., Oliver, B., Chan, Y. L., Cortie, M. B., Milthorpe, B. K., & Valenzuela, S. M. (2018). Gold nanoparticles improve metabolic profile of mice fed a high-fat diet. Journal of Nanobiotechnology, 16(1). https://doi.org/10.1186/s12951-018-0338-1
di Mascolo, D., Lyon, C. J., Aryal, S., Ramirez, M. R., Wang, J., Candeloro, P., Guindani, M., Hsueh, W. A., & Decuzzi, P. (2013). Rosiglitazone-loaded nanospheres for modulating macrophage-specific inflammation in obesity. Journal of Controlled Release, 170(3), 460–468. https://doi.org/10.1016/j.jconrel.2013.06.012
el Hadi, H., di Vincenzo, A., Vettor, R., & Rossato, M. (2019). Food ingredients involved in white-to-brown adipose tissue conversion and in calorie burning. In Frontiers in Physiology (Vol. 10, Issue JAN). Frontiers Media S.A. https://doi.org/10.3389/fphys.2018.01954
González Jiménez, E. (2013). Obesity: Etiologic and pathophysiological analysis. Endocrinología y Nutrición (English Edition), 60(1), 17–24. https://doi.org/10.1016/j.endoen.2013.01.005
Jiang, C., Cano-Vega, M. A., Yue, F., Kuang, L., Narayanan, N., Uzunalli, G., Merkel, M. P., Kuang, S., & Deng, M. (2017). Dibenzazepine-Loaded Nanoparticles Induce Local Browning of White Adipose Tissue to Counteract Obesity. Molecular Therapy, 25(7), 1718–1729. https://doi.org/10.1016/j.ymthe.2017.05.020
Khera, R., Murad, M. H., Chandar, A. K., Dulai, P. S., Wang, Z., Prokop, L. J., Loomba, R., Camilleri, M., & Singh, S. (2016). Association of pharmacological treatments for obesity with weight loss and adverse events a systematic review and meta-analysis. JAMA – Journal of the American Medical Association, 315(22), 2424–2434. https://doi.org/10.1001/jama.2016.7602
Lei Gao, Yangxi Hu, Desheng Hu, Ying Li, Songpeng Yang, Xing Dong, Sulaiman Ali Alharbi, & Hansong Liu. (2020). Anti-Obesity activity of gold nanoparticles synthesized from Salacia Chinensis modulates the Biochemical alterations in high-fat diet- induced obese rat model via AMPK signaling pathway. Arabian Journal of Chemistry, 13, 6589–6597.
Lin, X., & Li, H. (2021). Obesity: Epidemiology, Pathophysiology, and Therapeutics. In Frontiers in Endocrinology (Vol. 12). Frontiers Media S.A. https://doi.org/10.3389/fendo.2021.706978
Mayoral, L. P. C., Andrade, G. M., Mayoral, E. P. C., Huerta, T. H., Canseco, S. P., Rodal Canales, F. J., Cabrera-Fuentes, H. A., Cruz, M. M., Pérez Santiago, A. D., Alpuche, J. J., Zenteno, E., Ruíz, H. M., Cruz, R. M., Jeronimo, J. H., & Perez-Campos, E. (2020). Obesity subtypes, related biomarkers & heterogeneity. In The Indian journal of medical research (Vol. 151, Issue 1, pp. 11–21). NLM (Medline). https://doi.org/10.4103/ijmr.IJMR_1768_17
Redinger, R. (2007). The Pathophysiology of Obesity and Its Clinical Manifestations. In Gastroenterology & Hepatology (Vol. 3, Issue 11).
Simu, S. Y., Ahn, S., Castro-Aceituno, V., Singh, P., Mathiyalagan, R., Jiménez-Pérez, Z. E., Hurh, J., Oi, L. Z., Hun, N. J., Kim, Y.-J., & Yang, D.-C. (2018). Gold Nanoparticles Synthesized with Fresh Panax ginseng Leaf Extract Suppress Adipogenesis by Downregulating PPAR γ /CEBP α Signaling in 3T3-L1 Mature Adipocytes . Journal of Nanoscience and Nanotechnology, 19(2), 701–708. https://doi.org/10.1166/jnn.2019.15753
Toita, R., Kawano, T., Murata, M., & Kang, J. H. (2016). Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials, 110, 81–88. https://doi.org/10.1016/j.biomaterials.2016.09.018
Yaşacan, M., Erikçi, A., Eylem, C. C., Çiftçi, S. Y., Nemutlu, E., Ulubayram, K., & Eroğlu, İ. (2020). Polymeric Nanoparticle Versus Liposome Formulations: Comparative Physicochemical and Metabolomic Studies as l-Carnitine Delivery Systems. AAPS PharmSciTech, 21(8). https://doi.org/10.1208/s12249-020-01852-4